Как отличить метиловый от этилового спирта?
Как различить спирты
Отличить ядовитый технический спирт от питьевого чрезвычайно трудно. Именно по этой причине и случаются случаи смертельных отравлений. Когда под видом этанола используют для приготовления алкогольной продукции метанол.
Но отличить спиртовые соединения все же можно. Для этого существуют нехитрые способы, применить которые можно и в домашних условиях.
- С помощью огня. Это самый легкий метод проверки. Просто подожгите алкогольный напиток. Этанол при горении горит синим пламенем, а вот цвет горящего метанола зеленый.
- С использованием картофеля. Залейте спиртным кусочек сырой картошки и оставьте на 2—3 часа. Если цвет овоща не поменялся – водка отличного качества и ее смело можно употреблять по назначению. А вот в случае когда картофель приобрел розоватый оттенок – это следствие присутствия в алкоголе технического спирта.
- С применением медной проволоки. Проволочку следует раскалить докрасна и опустить в жидкость. Если при шипении пойдет едкий отталкивающий запах – в спиртном присутствует метанол. Этиловый спирт никак пахнуть не будет.
- Измеряя температуру кипения. Следует при помощи обычного термометра замерять температуру кипения спиртов. При этом учитывайте, что метанол кипит при +64⁰С, а этанол – при +78⁰С.
- Применяя соду и йод. Налейте в прозрачную емкость проверяемый алкоголь. К нему добавьте щепоточку обычной соды. Хорошо размешайте и капните к ней йод. Теперь просмотрите жидкость на просвет. Если в ней присутствует осадок – это свидетельство «чистоты» алкоголя. Этанол при взаимодействии с йодоформом (йод+сода) дает желтоватую взвесь. А вот метанол совершенно не меняется и остается прозрачным.
- С помощью марганцовки. В проверяемый алкоголь добавьте несколько кристалликов калия перманганата. Как только он растворится, и жидкость приобретет розовый окрас, нагрейте ее. Если при нагревании станут выделяться газовые пузырьки – перед вами ядовитый метиловый спирт.
Но стоит учитывать, что все эти и подобные бытовые методы не сработают, если технический спирт изначально в одном продукте будет смешан с этанолом. В данном случае помочь сможет лишь химическая экспертиза. И ответственный подход к покупке спиртного.
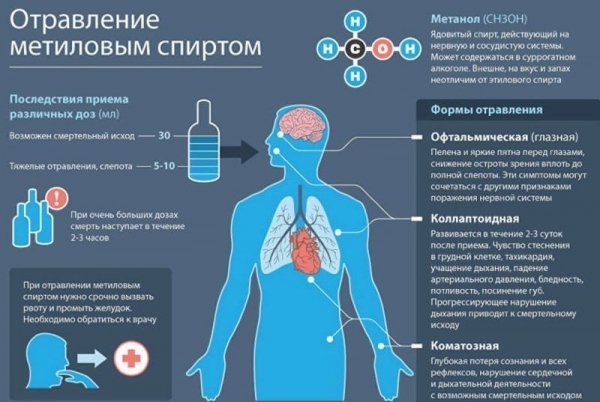
При неоказании помощи смерть от отравления метанолом наступает спустя 2—3 часа
Чтобы не приобрести потенциально опасный алкоголь, покупайте спиртное только в проверенных местах, специализированных магазинах, которые вызывают доверие. Избегайте подпольных лавок и небольших ларечков. Именно там очень часто распространяются подделки.
Немного о спирте

Истоки алкоголя идут еще с библейских времен, Ной, не заметив, что сок испортился, забродил, выпил его и опьянел. Именно тогда и начинается отсчет культуры виноделия и алкогольных опытов.
Основу создания спирта составляет процесс дистилляции, отсюда и пошло название, ведь полученный продукт называли «spiritus vini».
Именно в 14 веке произошел всплеск открытий, когда в каждой точке земли получение этого продукта достигалось различными новыми методиками.

Основные этапы развития и распространения:
- В 30-х годах 14 века алхимиком Вилльгером был получен винный спирт из вина.
- В 80-х годах купец привез из Италии в Москву этанол.
- В 20-х годах 16 века Парацельс выявил основное свойство этила – снотворное, проведя опыт над птицами.
- Спустя 2 века был усыплен первый пациент, для проведения операции.
- Примерно до 1914 года на территории СССР было около 2,5 тысячи заводов по производству, а во время войны это количество снизилось практически на 90%.
- В 1948 году наладилось производство, были усовершенствованы старые методики и разработаны новые технологии.
Виды:
- Технический или метиловый – его изготовляют из древесины или продуктов на основе нефти. Подвергают его кислотному гидролизу, что делает его вредным для здоровья человека.
- Производство пищевого, медицинского или этилового – осуществляют только из продуктов, разрешенных к употреблению, т.е. из пищевого сырья. В основном используют картофель, пшеницу, просо, кукурузу и т.д. Очень редко используют плоды деревьев, и иные растения, богатые углеводами.
Как уже было сказано, отличить технический вид от питьевого достаточно сложно. Именно поэтому все чаще отравления, а то и смерти, случаются из-за незнания. Осуществляется применение технического спирта в промышленности, в изготовлении растворителей, бытовой химии, но порой его продают под видом этилового.

Основные методы определения:
- Изготовитель. Следует приобретать напиток только в тех магазинах, что вызывают доверие, поскольку в такие магазины не осуществляют поставки поддельной продукции, что не скажешь о ларечках или подпольных магазинчиках. Употребляйте алкоголь от известных ликероводочных компаний или, в крайнем случае, медицинский спирт, тогда вы не подвергнете себя опасности.
- Поджечь напиток. Самый легкий способ проверить качество. Цвет этилового, при поджигании – синий, метанола – зеленый.
- Клубень картофеля. Перед употреблением напитка, бросьте в небольшую чашу кусочек картошки и залейте ее спиртом. Если цвет не изменился, то перед вами чистый настой и смело можете пить его, если приобрел розоватый оттенок – технический вид.
- Проба медной проволокой. Ее раскаляют и помещают в чашу с жидкостью, если имеется резкий терпкий запах – метанол, запах этила вы не распознаете, его нет.
Полезные свойства:
- Отличный антисептик и растворитель для лекарственных препаратов;
- Используется при простудных заболеваниях, для растирания, чтобы сбить температуру.
- Является чистым продуктом (пищевой), который не содержит в себе никаких примесей, как вино или пиво.
Кроме этого используется для создания лечебных настоек из разных трав:
- Эвкалиптовая настойка для лечения дыхательной системы;
- Настойка из розы для лечения сердечно-сосудистой системы;
- Настойку из мяты для успокоения нервов, снятия стресса;
- С календулой придаст бодрости и сил;
- Сужает рыхлые вены компресс каштановой настойки;
Отрицательное воздействие:
- Токсическое воздействие на все органы человеческого организма;
- Превышение индивидуальной нормы, может привести к сильному отравлению или даже к смерти. Общая смертельная доза 10 грамм на килограмм веса.
- Способствует развитию гастрита, язвы, рака, цирроза и т.д.
- Приводит к отмиранию клеток головного мозга – нейронов.
- Вызывает зависимость, что приводит к алкоголизму.
- Способствует ожирению, поскольку является очень калорийным напитком, а также вызывает аппетит.
- Слишком высокая концентрация этанола для человека, допустимая, даже лечебная норма в день 30 мл.
Этиловый спирт детям
Абсолютных противопоказаний к использованию у детей данного раствора не имеется. Однако будьте внимательны, спирт имеет системное отравляющее действие, особенно ярко проявляющееся у детей. Потому даже при наружном применении не увлекайтесь растирками и примочками.
Есть часть настоек и препаратов, основанных на спирте, которые в некоторых случаях разрешены для приема детям. Будьте внимательны и осторожны, внимательно читайте состав препарата и инструкцию к применению
Обращайте внимание на состояние и поведение своего ребенка. Использование подобных средств, а особенно в повышенной дозировке, могут вызвать серьезные симптомы алкогольного отравления у ребенка
Примеры решения задач
| Задание | Определите простейшую формулу соединения калия с марганцем и кислородом, если массовая доля калия равна 24,7%, марганца 34,8%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Вычислим массовую долю кислорода в соединении:
ω (P) = 100% — ω(K) — ω(Mn)= 100% — 24,7% — 34,8% = 40,5%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (марганец) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(K)/Ar(K) : ω(Mn)/Ar(Mn) : ω(O)/Ar(O);
x:y:z= 24,7/39 : 34,8/55 : 40,5/16;
x:y:z= 0,63 : 0,63:2,53 = 1 : 1: 4.
Значит формула соединения калия, марганца и кислорода будет иметь вид KMnO4. Это перманганат калия.
Ответ
KMnO4
| Задание | Выведите простейшую формулу соединения, в котором массовая доля фосфора составляет 43,66%, а массовая доля кислорода – 56,34%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов фосфора в молекуле через «х», а число атомов кислорода через «у»
Найдем соответствующие относительные атомные массы элементов фосфора и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(P) = 31; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y = ω(P)/Ar(P) : ω (O)/Ar(O);
x:y = 43,66/31 : 56,34/16;
x:y: = 1,4 : 3,5 = 1 : 2,5 = 2 : 5.
Значит простейшая формула соединения фосфора и кислорода имеет вид P2O5. Это оксид фосфора (V).
Без алкогольных напитков не обходится ни один праздник. И, конечно, всем известно, что в состав любого горячительного входит питьевой этиловый спирт. Именно он и приносит человеку ощущение приятной эйфории и расслабленности и тяжелейшие симптомы интоксикации в случае его чрезмерного употребления. Но некоторый алкоголь несет с собой смерть.
Это связано с производством суррогатного алкоголя, где используется не этиловый, а метиловый спирт, токсичный и чрезвычайно ядовитый продукт. Оба вида соединения практически ничем не отличаются внешне, различен лишь их химический состав. Давайте, разберемся, какая же формула питьевого спирта в химии и в чем разница его со спиртом метиловым.
Свойства
Смешивается с водой во всех соотношениях. Этанол хорошо растворяет многие органические вещества. Безводный (абсолютный) спирт кипит при 78,37oС. Получаемый в промышленности спирт-ректификат представляет собой смесь 95,5% этанола и 4,4% воды, которая кипит при 78,37oС (смеси определенного состава, кипящие при постоянной температуре, называют азеотропными смесями).
Основные константы этилового спирта приведены в таблице ниже.
Таблица 1. Физические свойства этилового спирта.
|
Плотность, г/см3 |
0,7893 |
|
Температура плавления, oС |
-114,3 |
|
Температура кипения, oС |
78,4 |
|
Молярная масса, г/моль |
46,069 |
— атома водорода гидроксильной группы;
— гидроксильной группы;
— атома водорода гидроксильной группы и связи Cα-H;
— гидроксильной группы и связи Cβ-H.
1) O-H
— взаимодействие с активными металлами
— взаимодействие с органическими и кислородсодержашими неорганическими кислотами
C2H5OH CH3COOH C2H5-O-C(O)-CH3 H2O (H2SO4 (conc), t0);
C2H5OH HONO2C2H5ONO2 H2O (H2SO4 (conc), t0).
2) C-OH;
— взаимодействие с галогеноводородами
— взаимодействие с тригалогенидамифосфора
3C2H5OH PBr3→ 3C2H5Br H3PO3.
— взаимодействие с аммиаком
C2H5OH NH3→ C2H5NH2 H2O (Al2O3, t0 = 300).
3) O-H и Cα-H;
— дегидрирование
— окисление
CH3-CH2-OH 2 → CH3-COOH H2O (kat, t0).
4) C-OH и Cβ-H
— внутримолекулярная дегидратация
CH3-CH2-OH → CH2=CH2 H2O (Al2O3, t0).
Этанол
Aethanolum (
Aethanoli)
Он смешивается с водой во всех соотношениях и образует с ней азеотропные смеси (смеси определенного состава, кипящие при постоянной температуре, называют азеотропными смесями). Безводный этанол называют абсолютным спиртом, температура плавления которого составляет 78,37oС.
Рис. 1. Строение молекулы этанола.
Таблица 1. Физические свойства этанола.
1) O-H
взаимодействие с активными металлами
взаимодействие с органическими и кислородсодержашими неорганическими кислотами
C2H5OH HONO2 C2H5ONO2 H2O (H2SO4 (conc), to).
2) C-OH;
взаимодействие с галогеноводородами
C2H5OH HCl → C2H5Cl H2O (ZnCl2, to).
взаимодействие с тригалогенидами фосфора
взаимодействие с аммиаком
C2H5OH NH3→ C2H5NH2 H2O (Al2O3, to = 300).
3) O-H и Cα-H;
ЧИТАТЬ ЕЩЕ Может ли с похмелья подняться температура — причины возникновения высокой температуры
CH3-CH2-OH 2 → CH3-COOH H2O (kat, to).
4) C-OH и Cβ-H
внутримолекулярная дегидратация
CH3-CH2-OH → CH2=CH2 H2O (Al2O3, to).
Внешний вид: в обычных условиях представляет собой бесцветную летучую жидкость с характерным запахом. Следует избегать популярной ошибки: часто смешивают свойства 95.57 % спирта и абсолютизированного. Их свойства почти одинаковы, но величины начинают различаться начиная с 3 — 4-ой значащей цифры.
| Молекулярная масса | 46,069 а. е. м. |
| Температура плавления | −114,15 °C |
| Температура кипения | 78,15 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | смешивается с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | 1,3611
(температурный коэффициент показателя преломления 4,0·10−4, справедлив в интервале температур 10—30 °C) |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 4,81 кДж/моль |
| Энтальпия кипения ΔHкип | 839,3 кДж/моль |
| Температура, °C | 10 | 20 | 30 | 40 | 50 | 60 | |
| ρ, г/см³ | 0,8062 | 0,7979 | 0,7893 | 0,7810 | 0,7722 | 0,7632 | 0,7541 |
| Массовое содержание C2H5OH, % | 1 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| ρ, г/см³ | 0,99636 | 0,99453 | 0,99103 | 0,98780 | 0,98478 | 0,98187 | 0,97910 | 0,97643 | 0,97387 |
| Массовое содержание C2H5OH, % | 18 | 20 | 22 | 24 | 26 | 28 | 30 | 35 | 40 |
| ρ, г/см³ | 0,97129 | 0,96864 | 0,96592 | 0,96312 | 0,96020 | 0,95710 | 0,95382 | 0,94494 | 0,93518 |
| Массовое содержание C2H5OH, % | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| nD20 | 1,3396 | 1,3470 | 1,3535 | 1,3580 | 1,3612 | 1,3633 | 1,3646 | 1,3649 | 1,3642 | 1,3613 |
| Температура, °C | 10 | 20 | 30 | 40 | 50 | 60 | |
| σ, Н/м | 2,405·10−2 | 2,314·10−2 | 2,203·10−2 | 2,148·10−2 | 2,020·10−2 | 1,980·10−2 | 1,843·10−2 |
| Давление, кПа (мм. рт. ст.) | 0,133(1) | 0,667(5) | 1,333(10) | 2,666(20) | 5,333(40) |
| Tкип, °C | −31,3 | −12,0 | −2,3 | 8,0 | 19,0 |
| Давление, кПа (мм. рт. ст.) | 7,999(60) | 13,333(100) | 26,66(200) | 53,33(400) | 101,32(760) |
| Tкип, °C | 26,0 | 34,9 | 48,4 | 63,5 | 78,4 |
Смесь 96 % спирта и 4 % воды (95.57 % этанола 4.43 % воды) является азеотропной — т. е. не разделяется при перегонке.
С2Н5ОН 40 % H2O 60 %
Состав по ГОСТу
В «правильной» водке не должно быть ничего, кроме воды и спирта. Поэтому она лишена вкуса, запаха и вообще какой-либо специфики.
В 1936 году в СССР был принят первый ГОСТ, согласно которому напиток крепостью 40 градусов из воды и этилового спирта получил название «водка». Все прочие, обогащенные добавками, именовались «винно-водочными изделиями».
Сегодня мы живем по ГОСТу 12712-2013. Он был принят в 2014 году. Там все та же информация: водка состоит из этилового спирта и воды. Уточняется, что для очищения и обогащения водки можно использовать:
- сахар;
- лимонную и соляную кислоту;
- мед;
- ванилин;
- активированный уголь;
- соль;
- фруктозу и некоторые другие вещества. Все – в минимальных дозировках.

Водка в нашей стране подразделяется на 4 класса.
- «Эконом». Производится из спирта категории «Экстра». Проходит одну очистку.
- «Стандарт». Эта водка дороже. Используется спирт «Экстра», 2-3 степени очистки.
- «Премиум». Разрешаются спирты «Альфа» и «Люкс». Они чище. Водка значительно дороже, но ее отличает мягкий вкус.
- «Супер премиум». Те же спирты «Альфа» и «Люкс» плюс специально очищенная либо родниковая вода. Дополняется процедурой очистки золотом или серебром.
Есть еще класс «Ультра премиум». Разница с «Супер премиум» — в основном в цене.
Разновидности спирта
Алкоголь обладает множеством различных модификаций. Некоторые виды спиртов тесно соприкасаются с пищевыми технологиями, другие являются ядовитыми. Чтобы узнать их действие и влияние на человеческий организм, следует понимать их главные характеристики.
Пищевой (или питьевой)
Или спирт этиловый. Его получают способом ректификации (процесс разделения многокомпонентных смесей с использованием теплообмена между жидкостью и паром). За сырье для его приготовления берутся различные виды зерен. Химическая формула питьевого этилового спирта следующая: С2Н5ОН.

Как действует этиловый спирт
Пищевой этанол обладает и собственными разновидностями (они зависят от видов сырья, которое было использовано). Классификация питьевого спирта имеет следующие виды:
Спирт I сорта (или медицинский)
Его не используют для выпуска алкогольной продукции. Данное соединение предназначено для использования исключительно в медицинских целях в качестве антисептика, обеззараживания операционных и хирургических инструментов.
Альфа
Спиртовое соединение высшего сорта. Для его изготовления берется отборная высококачественная пшеница или рожь. Именно на базе спирта Альфа выпускается элитные алкогольные напитки суперпремиумкласса. Например:
- ром Bacardi;
- водка Absolut;
- виски Jack Daniels;
- виски Johnnie Walker.
Люкс
Для производства питьевого этанола данного уровня используют картофель и зерно, с учетом, что на выходе объем картофельного крахмала не должно превышать 35%. Спиртовое соединение пропускается через несколько ступеней фильтрации. Из него выпускают водку премиум-класса. Такую, как:
- Хаски;
- Радуга;
- Белуга;
- Мамонт;
- Nemiroff;
- Столичная;
- Русское золото;
- Русский стандарт.
Данные водочные напитки обладают несколькими степенями защиты. У них особенная форма бутыли, специально разработанные голограммы, уникальный колпачок.

Как проверяют качество водочных изделий
Экстра
На его основе делают классическую и многим знакомую водку среднеценового сегмента. Данный питьевой спирт разбавляют (его крепость в неразбавленном виде составляет около 95%) и плюс ко всему подвергают дополнительной очистке. Итоговая продукция обладает меньшим содержанием сложных эфиров и метанола. Алкоголь на базе данного соединения считается экологически чистым продуктом, правда, не таким дорогим, как спиртное на базе Альфа либо Люкса.
Базис
Практически не уступает водочным этанолам Экстра и Альфа. Обладает такой же высокой крепостью (порядка 95%). Водка, изготовленная из этого питьевого спирта, является самым ходовым товаром, так как она наиболее доступна (средний ценовой сегмент рынка). Производят спирт этой марки из картофеля и зерна, с учетом, что объем картофельного крахмала в получаемой продукции не превышает 60%.

Широкое распространение имеет этиловый спирт в медицине
Спирт высшей категории очистки
Изготавливают его на базе смеси следующих продуктов:
- зерно;
- картофель;
- черная патока;
- сахарная свекла.
Данное соединение при технологическом процессе подвергается минимальной обработке и отфильтровыванию от различных примесей и сивушных масел. Его пускают на изготовление дешевой водки экономкласса, различных настоек и ликеров.
Спирт метиловый (или технический)
Бесцветное, прозрачное вещество, по запаху схожее с классическим этанолом. Но, в отличие от последнего, метанол представляет собой высокотоксическое соединение. Химическая формула метанола (или древесного спирта) СН3ОН. При попадании в человеческий организм это соединение вызывает острое отравление. Не исключен и летальный исход.
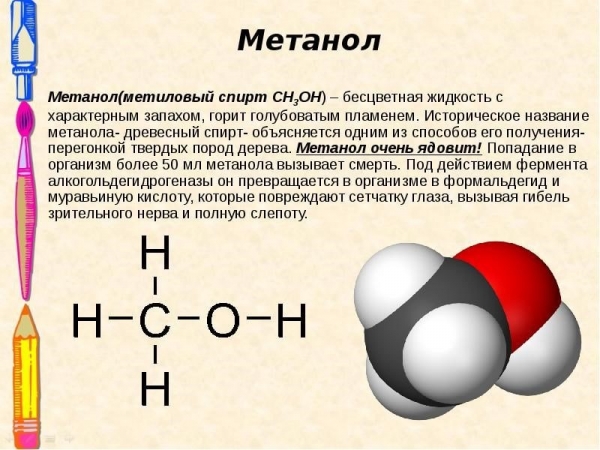
Что такое метиловый спирт
Метиловый спирт не имеет никакого отношения к производству алкопродукции и пищевой промышленности. Но этим дешевым средством часто разбавляется суррогатный алкоголь ради удешевления получаемой продукции. При взаимодействии с органическими структурами метанол превращается в страшнейший яд, который погубил уже немало жизней.
Микробиологическая чистота
В соответствии с ОФС «Микробиологическая чистота.
История этанола
Истоки знакомства с алкоголем уходят корнями еще в легендарное библейское прошлое. Ной, отведав забродивший виноградный сок, впервые познал ощущение похмелья. Именно с этого момента и начинается триумфальное шествие алкогольной продукции, развитие винодельческой культуры и многочисленные спиртные опыты.
Spiritus vini – такое название получил питьевой спирт, который стали создавать методом дистилляции. То есть перегонкой и испарением жидкости с последующим оседанием пара в жидкую форму.

Формула этанола была установлена в 1833 году
Точкой отсчета виноделия и производства алкогольной продукции стал XIV век. Именно с этого времени получением «волшебной» жидкости занялись в различных странах с созданием и развитием многочисленных методик. К важным этапам распространения этанола, как по-научному называется питьевой спирт, и его развития можно отнести следующие года:
- XIV век (30-е годы). Впервые французским алхимиком Арно де’Вилльгер был открыт винный спирт, ученый смог выделить его из вина.
- XIV век (80-е годы). Итальянский купец познакомил с этиловым спиртовым соединением древних славян, привезя это вещество в Москву.
- XVI век (20-е года). Легендарный швейцарский врач, алхимик Парацельс вплотную занялся изучением свойств этанола и выявил его главную способность – усыплять.
- XVIII век. Впервые снотворные способности этилового спирта были испытаны на человеке. С его помощью был впервые усыплен пациент, которого готовили к сложной операции.
С этого момента начался бурный рост спиртоводочной промышленности. На территории одной лишь нашей страны вплоть до начала революции активно функционировало более 3 000 спиртовых заводов. Правда, во время ВОВ их число резко сократилось, почти на 90%. Возрождение началось лишь в конце 40-х годов прошлого века. Стали вспоминать старинные технологии и разрабатывать новые.
Плотность разных видов вина
В первую очередь этот параметр у напитка — термин дегустационный, он определятся по внешнему виду вина, по тому, как оно переливается и колеблется в бокале. В зависимости от этого параметра капли напитка оставляют на стенках бокала разный по виду след. Данный параметр указывается наравне с остальными характеристиками вин: кислотностью, сладостью, танинностью. Чем ниже уровень алкоголя и сахара в вине, тем он получается плотнее и тяжелее.
Соответственно, наиболее легкими винами являются сухие, содержащие в себе минимум спирта и сахара. Характеристика сухого вина при температуре 20°С — 993 кг/м³. Для сравнения, эта характеристика воды при такой же температуре — 1000 кг/м³. Данный параметр плотности касается как белого, так и красного вина.
Вода принимается за эталон как наиболее распространенная на планете жидкость, и с ней сравнивают остальные виды жидкостей. Ее плотность тоже колеблется в зависимости от вида и консистенции. У дистиллированной воды значение 1000 кг/м³, а у морской — 1030 кг/м³. Могут быть и промежуточные версии, зависящие от содержащихся в воде примесей.
Читайте также: Как сделать рисовую «Сакэ» в домашних условиях? Саке это вино или водка?
Величина плотности напрямую связана с температурой, поэтому важно учитывать, что эти значения справедливы для температуры 3,7°С. У кипящей воды показатель понизится и будет равняться 958,4 кг/м³
Данная характеристика практически всегда уменьшается при нагревании жидкостей — это общее правило.
Параметры воды в этом отношении аналогичны со многими другими пищевыми продуктами: молоком с небольшой жирностью, раствором уксуса, сливками 20%-ной жирности, вином. Некоторые из продуктов плотнее по составу: желток яйца (1042 кг/м³), соки — ананасовый, апельсиновый, виноградный, а еще кока-кола и другие виды газировки.
Спирты, наоборот, легче воды, причем сильно. Например, у этилового спирта параметр равняется 789 кг/м³. Также легче воды многие виды масел и топлива: нефть, бензин. Еще легкими жидкостями являются керосин, мазут и дизельное топливо. Эффект разницы в плотности можно легко увидеть: нефть и масло растекаются по поверхности воды как раз за счет того, что легче.
Применение
В химической промышленности применение этанола, безусловно, весьма широко. Вот некоторые из применений: используется как растворитель (бытовая химия, лакокрасочные изделия); входит в состав антифризов и жидкостей для омывания стёкол; применяется в моющих средствах, и это только немногие применения этанола.
Спирт применяется в медицине, прежде всего как антисептик. Растворитель всевозможных лекарств
ЧИТАТЬ ЕЩЕ Соседи алкоголики и дебоширы: как выселить, что делать, заявление (образец)
В медицине применение спирта очень важная составляющая и нельзя недооценивать важность этила.
Используется в парфюмерии как основной компонент духов, одеколонов и аэрозолей. Входит в состав зубных паст, различных шампуней, гелей для душа и т
п.
Бесспорно, необходимо отдать должное Арно де Вильггер, а также другим алхимикам, за то, что они изобрели формулу этила. Применение этила является важнейшим аспектом как в медицине, так и в парфюмерии как производстве, так и в химии. С2Н5ОН — химическая формула спирта, известная практически каждому ещё со школьной скамьи, по крайне мере тем, кто хоть немного, слушал на уроках все, что связано со словом «химический».
Невозможно не затронуть такую тонкую тему вреда и пользы алкоголя. Как многие привыкли считать, алкоголь в небольших дозах полезен, но, к сожалению, доля пользы несопоставима с долей вреда который алкоголь приносит. Из пользы можно выделить незначительное предотвращение формирования тромбоза, что само по себе приводит к хорошему кровообращению. А вот из вредных аспектов выделим то, что алкоголь может внести изменение в генетическую структуру человека, может повлиять на отклонения у новорождённых детей, помимо этого, не стоит и говорить о том влиянии которое алкоголь оказывает на поведение человека.
Больше всего изнасилований и преступлений в целом было совершено в алкогольном опьянении, что в целом полностью говорит о пагубности употребления алкогольных напитков.
В конце статьи, хотелось бы подвести итог. Несомненно, польза этилового спирта неоспорима! Употребление алкоголя это немалый минус, с которым нужно бороться, но борьба начинается с нас самих.
Еще со школьной скамьи я помню, что формула этанола или же этилового спирта такая: С2Н5ОН. Этанол — это производное алкана «этан» — С2Н6.
Напомним, что общей формулой для одноатомных спиртов, к которым и относится этанол является формула: CnH2n+1OH.

Этиловый спирт (этанол, насыщенный спирт) многим известен не понаслышке. Он очень широко применяется в медицине, в некоторой парфюмерии, в быту и является составной частью большинства спиртных напитков.
Но не все знают химическую формулу этого распространённого вещества. Между тем, она не сложна: химическая формула этилового спирта — C2H5OH.
Меня в школе вообще мало что интересовало на предмете химия. Я ее не понимал и поэтому не любил.
Формулу воды запомнил наверно только потому что она была нацарапана на каждой парте..)
Вот и сейчас, что бы ответить на этот вопрос, пришлось полистать не один источник и убедиться в том что формула вещества C2H5OH действительно в просторечии называется этанол, этиловый спирт.
Отличия
В домашних условиях можно провести несложные опыты для выявления отличий. Приведем три важных способа отличия метанола от этанола. Эти же способы будут носить и сравнительный характер.
1 способ. Поджигание исследуемой жидкости. Один из самых простых и надежных способов: поджигаем наш образец, следим за цветом пламени. Этанол горит синим цветом, а метанол – зеленым. Это же так просто и понятно, но помните, что незнание, к сожалению, не освобождает человека от последствий.
Введем новое понятие в нашей статье – технический спирт. Под понятием «технический спирт» понимаем спирты (метанол, денатурат) и их смеси, не пригодные для употребления человеком, наносящие серьезный и непоправимый урон как здоровью, так и жизни.
Также нужно учесть следующий момент: используя градусник в нашем простом опыте, надо зафиксировать температуру закипания, так как известно из разделов химии, что этанол закипает при температуре 78° по Цельсию, а метанол достигает кипения уже при 64°.
2 способ. Используем обыкновенный картофель. Небольшую дольку картофеля на несколько часов нужно бросить в исследуемую жидкость: если по истечении указанного времени картофель не поменял цвет, то перед вами этанол — вещество, пригодное для употребления. Если же долька картофеля окрасилась в розовый цвет, то исследуемая жидкость является метанолом – сильнейшим ядом для организма человека.
3 способ. Формальдегидная проба. Здесь нам понадобится медная проволока, небольшую часть которой необходимо накалить добела и опустить в жидкость. При нахождении в ней этанола можно почувствовать запах прелых яблок, а там, где находится метанол, вы услышите резкий неприятный запах – запах формальдегида.
Помните, что небольшая доза (хватает и 50 мл) метанола может привести к смертельному исходу. Будьте бдительны, не покупайте алкогольные напитки в сомнительных точках продаж, не рискуйте жизнью и здоровьем, а покупайте алкоголь в специализированных магазинах.
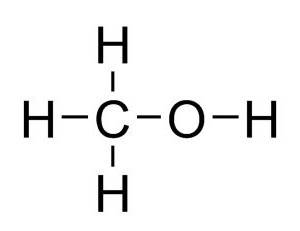
Сложные эфиры
Не более 0,0011 % (о/о, не более 10 мг/л) в пересчете на спирт этиловый безводный.
Определение проводят методом ГХ. Условия хроматографирования приведены в разделе «Метанол».
Содержание сложных эфиров (метилацетат, этилацетат) в субстанции (X) в процентах (о/о) в пересчете на спирт этиловый безводный рассчитывают по формуле:
Хi – концентрация каждого из сложных эфиров, рассчитанная по формуле:
Si – площадь пика каждого сложного эфира (метилацетат, этилацетат) на хроматограмме субстанции;
S – площадь пика каждого сложного эфира (метилацетат, этилацетат) на хроматограмме градуировочной смеси;
Сi – концентрация каждого сложного эфира (метилацетат, этилацетат) в градуировочной смеси, мг/л;
ρi – плотность каждого сложного эфира, равная 0,924 г/мл для метилацетата и 0,901 г/мл для этилацетата соответственно;
P – содержание спирта этилового в субстанции, % (о/о), рассчитанное по плотности субстанции.
Получение спиртов.
Некоторые из показанных выше реакций (рис. 6,9,10) обратимы и при изменении условий могут протекать в противоположном направлении, приводя к получению спиртов, например при гидролизе сложных эфиров и галогенуглеводородов (рис.11А и Б, соответственно), а также гидратацией алкенов – присоединением воды (рис.11В).
Реакция гидролиза алкенов (рис. 11, схема В) лежит в основе промышленного производства низших спиртов, содержащих до 4 атомов С.
Этанол образуется и при так называемом спиртовом брожении сахаров, например, глюкозы С6Н12О6. Процесс протекает в присутствии дрожжевых грибков и приводит к образованию этанола и СО2:
С6Н12О6 2С2Н5ОН + 2СО2
Брожением можно получить не более чем 15%-ный водный раствор спирта, поскольку при более высокой концентрации спирта дрожжевые грибки погибают. Растворы спирта более высокой концентрации получают перегонкой.
Метанол получают в промышленности восстановлением монооксида углерода при 400° С под давлением 20–30 МПа в присутствии катализатора, состоящего из оксидов меди, хрома, и алюминия:
СО + 2 Н2 Н3СОН
Если вместо гидролиза алкенов (рис. 11) проводить окисление, то образуются двухатомные спирты (рис. 12)
Применение спиртов
Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт объясняется одним из путей его получения способом перегонки твердых пород дерева (греч. methy — вино, опьянеть; hule — вещество, древесина).
Метанол требует осторожного обращения при работе с ним. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения
Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96 % (по объему) этанола и 4 % (по объему) воды. Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди (II) и др.).
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным, или денатуратом.
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания.
Пролактриол-1,2,3 (глицерин) — вязкая сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел.
Широко используется в косметике, фармацевтической и пищевой промышленностях. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание.
К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану. В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и, таким образом, придавая пластмассам необходимую гибкость и эластичность.
Из чего делают медицинский спирт

Основным сырьем для изготовления медицинского спирта является растительная масса, которая содержит много клетчатки, сахара и крахмала. В зависимости от этих показателей сырье разделяется на три класса:
- Клетковиносодержащее с использованием соломы, отходов сульфит-целлюлозной отрасли.
- Сахаросодержащее — из фруктов, мелассы, свеколицы.
- Крахмалосодержащее — из картофеля, а также зерновых культур.
Чистый медицинский спирт обычно получают посредством сбраживания картофеля либо зерна. Картофель быстро разваривается, засахаривается и клейстеризуется. Более того, спирт, полученный из картофеля — наиболее дешевый.
Зерно же можно брать любое, в том числе непригодное для кормового и пищевого направления. Полученное вещество концентрируется перегонкой до получения спирта-ректификата 95 %.